W. L. кі м–ҙ м•Ө м–ҙмҶҢмӢңм—җмқҙмё (W. L. Gore & Associates, Inc., мқҙн•ҳ вҖҳкі м–ҙвҖҷ)к°Җ мЈјмҡ” мһ„мғҒм—°кө¬м—җм„ң кі м–ҙ нғңк·ё нқүл¶Җ лӮҙмһҘ к°Җм§Җ мқёкіөмӮҪмһ…л¬ј(GOREВ® TAGВ® Thoracic Branch Endoprosthesis, м•Ҫм№ӯTBE)мқ„ мөңмҙҲлЎң мқҙмӢқн–ҲлӢӨкі мҳӨлҠҳ л°ңн‘ңн–ҲлӢӨ. мқҙ мқҙмӢқмҲ мқ„ л°ӣмқҖ нҷҳмһҗлҠ” лҜёмӢңк°„лҢҖн•ҷ н”„лһӯмјҲ мӢ¬нҳҲкҙҖм„јн„°(University of Michigan Frankel Cardiovascular Center) м„ұмқё мӢ¬мһҘмҲҳмҲ кіјмһҘмқҙл©° мһ„мғҒм—°кө¬мқҳ лҜёкөӯ лӮҙ кіөлҸҷ мҲҳм„қм—°кө¬мӣҗмқё нһҲл§ҢмҠҲ нҢҢн…”(Himanshu Patel) л°•мӮ¬к°Җ л“ұлЎқмӢңнӮЁ мӮ¬лһҢмқҙлӢӨ.
мқҙлІҲ м—°кө¬лҠ” лҢҖлҸҷл§Ҙк¶Ғкіј лӮҙлҰј нқүл¶Җ лҢҖлҸҷл§Ҙ(descending thoracic aorta)мқҳ л°•лҰ¬, мҷёмғҒ лҳҗлҠ” лҸҷл§ҘлҘҳлҘј нҸ¬н•Ён•ң лі‘ліҖмқҳ м№ҳлЈҢм—җ мһҲм–ҙ TBEмқҳ м•Ҳм „м„ұкіј нҡЁкіјлҘј нҢҗлӢЁн•ҳлҠ”лҚ° лӘ©м Ғмқҙ мһҲлӢӨ. мқҙ н•өмӢ¬ м—°кө¬лҠ” мғҒмҷ„л‘җл¶Җ(BCA) лҳҗлҠ” мўҢмҳЁлӘ©(LCC) лҸҷл§Ҙмқҳ мЎҙ(Zone) 0-1 л¶Җмң„м—җм„ң к°Җм§Җ л””л°”мқҙмҠӨ(branch device) мқҙмӢқмҲ м—җ лҢҖн•ң мЎ°кё° нғҖлӢ№м„ұ м—°кө¬мҷҖ мўҢмҮ„кіЁ н•ҳлҸҷл§Ҙ(LSA)мқҳ мЎҙ2 л¶Җмң„м—җм„ң к°Җм§Җ л””л°”мқҙмҠӨ мқҙмӢқмҲ м—җ лҢҖн•ң нғҖлӢ№м„ұ м—°кө¬лҘј мӢӨмӢңн•ң лҚ° мқҙм–ҙ мӢңн–үн•ҳлҠ” кІғмқҙлӢӨ. мқҙлІҲ м—°кө¬лҠ” мЎҙ0-2л¶Җмң„ лӮҙ к·јмң„л¶Җм—җ мқҙмӢқмҲ мқҙ н•„мҡ”н•ң нҷҳмһҗмқҳ лӘЁл“ лі‘мқё(з—…еӣ )мқҳ м№ҳлЈҢлҘј мң„н•ҙ лҜёкөӯ лӮҙ 40к°ң мӮ¬мқҙнҠём—җм„ң мӢӨмӢңн•ҳлҠ” кІғмңјлЎң, мөңлҢҖ 435лӘ…мқҳ нҷҳмһҗк°Җ л“ұлЎқн• кІғмңјлЎң мҳҲмғҒлҗңлӢӨ.
нһҲл§ҢмҠҲ нҢҢн…” л°•мӮ¬лҠ” вҖңмғҒмҡ©нҷ”лҗң TBEлҠ” к·ё лҸҷм•Ҳ м Ҳк°ң мҲҳмҲ кіј нҳҲкҙҖ лӮҙ кҙҖлҰ¬лҘј н•„мҡ”лЎң н–ҲлҚҳ лҢҖлҸҷл§Ҙк¶Ғ м§Ҳнҷҳмқҙ мһҲлҠ” нҷҳмһҗм—җкІҢ мғҲлЎңмҡҙ м№ЁмҠөм„ұмқҙ м•Ҫн•ң м№ҳлЈҢ мҳөм…ҳмқҙ лҗ кІғвҖқмқҙлқјл©° вҖңвҖҳкі м–ҙ нғңк·ё л””л°”мқҙмҠӨвҖҷлҠ” нҡҢмӮ¬ кі мң мқҳ кіҒк°Җм§Җ л””мһҗмқёкіј мЎ°нҷ”лЎӯкІҢ кІ°н•©н•ҳм—¬ лҢҖлҸҷл§Ҙк¶Ғ м§Ҳнҷҳмқ„ м№ЁмҠөм„ұмқҙ м•Ҫн•ҳкІҢ м№ҳлЈҢн•ЁмңјлЎңмҚЁ мғҒмҷ„л‘җл¶Җ, мўҢмҳЁлӘ© лҸҷл§Ҙ лҳҗлҠ” мўҢмҮ„кіЁ н•ҳлҸҷл§Ҙмқҳ кҙҖлҘҳлҘј мҲңмЎ°лЎӯкІҢ н•ңлӢӨвҖқкі л§җн–ҲлӢӨ.
м „нҶөм ҒмңјлЎң лҢҖлҸҷл§Ҙк¶Ғ м§ҲнҷҳмқҖ м№ҳлЈҢн•ҳкё°к°Җ м–ҙл Өмҡҙ м§Ҳлі‘мқҙлӢӨ. мқҙлҹ¬н•ң м§Ҳлі‘ м№ҳлЈҢлҘј мң„н•ҙ нҳ„мһ¬ мӮ¬мҡ© к°ҖлҠҘн•ң мҳөм…ҳл“ӨмқҖ м Ҳк°ң мҲҳмҲ , мҷёкіјм Ғ нҳҲкҙҖ мқҙмӢқмҲ мқ„ нҶөн•ң нҳјн•© м ‘к·ј л°©мӢқ лҳҗлҠ” мҠ№мқё м—Ҷмқҙ мІҳл°©лҗң л””л°”мқҙмҠӨлҘј мӮ¬мҡ©н•ҳлҠ” ліөн•© м№ҳлЈҢ м Ҳм°Ё л“ұ ліөмһЎн•ң м№ҳлЈҢ м Ҳм°Ёк°Җ н•„мҡ”н•ҳлӢӨ. мқҙлҹ¬н•ң нҷҳмһҗл“Өмқ„ мң„н•ң м№ҳлЈҢ мҳөм…ҳмқҙ м ңн•ңлҗҳм–ҙ мһҲкё° л•Ңл¬ём—җ кі м–ҙмқҳ TBEк°Җ мқҳлЈҢ л””л°”мқҙмҠӨлЎңм„ңлҠ” лҜёкөӯм—җм„ң мөңмҙҲлЎң лҜёкөӯ мӢқм•ҪмІӯ(FDA)мқҳ мғҲлЎңмҡҙ м ңлҸ„мқё мӢ мҶҚ м ‘к·ј кІҪлЎң(Expedited Access Pathway, EAP) м ңн’ҲмңјлЎң м§Җм •лҗҗлӢӨ. мқҙлҹ¬н•ң кІҪлЎңлҠ” мғқлӘ…мқ„ мң„нҳ‘н•ҳлҠ” м§Ҳнҷҳмқ„ мң„н•ҙ 충мЎұлҗҳм§Җ м•ҠмқҖ мқҳлЈҢ мҡ”кө¬лҘј л§ҢмЎұмӢңнӮӨкі кё°мЎҙ лҢҖмІҙ м ңн’Ҳм—җ 비н•ҙ нҷҳмһҗм—җкІҢ мқҳлҜё мһҲлҠ” нҺёмқөмқ„ м ңкіөн• к°ҖлҠҘм„ұмқҙ мһҲлҠ” кІғмқҙ мһ…мҰқлҗң мқҳлЈҢкё°кё°м—җл§Ң м ңн•ңм ҒмңјлЎң м§Җм •лҗңлӢӨ.
лҜёкөӯ лӮҙ кіөлҸҷ мҲҳм„қ м—°кө¬мӣҗмқё мҠӨнғ нҸ¬л“ңлҢҖн•ҷмқҳ л§ҲмқҙнҒҙ лҚ°мқҙнҒ¬(Michael Dake) л°•мӮ¬лҠ” вҖңм„ұкіөм Ғмқё нғҖлӢ№м„ұ м—°кө¬мҷҖ мЎ°кё° нғҖлӢ№м„ұ м—°кө¬ кІ°кіјлҘј л°”нғ•мңјлЎң мқҙмІҳлҹј нҳҒмӢ м Ғмқё л””л°”мқҙмҠӨлЎң кҙ‘лІ”мң„н•ң нҷҳмһҗл“Өмқ„ м№ҳлЈҢн•ҳлҠ”лҚ° мқҳлҜё мһҲлҠ” м§„м „мқ„ ліҙкІҢ лҗҳм–ҙ л§Өмҡ° кё°мҒҳлӢӨвҖқкі л§җн–ҲлӢӨ.
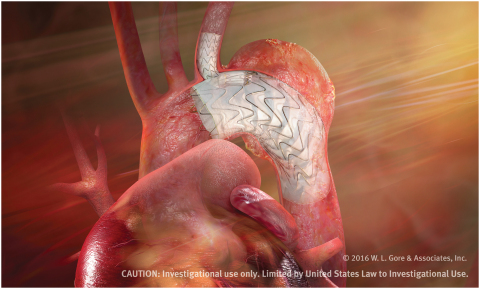
мһҘкё°м Ғмқё лӮҙкө¬м„ұмқ„ к°–лҸ„лЎқ кі м•Ҳлҗң кі м–ҙ нғңк·ёTBEлҠ” мЈјмҡ” мһ„мғҒ м—°кө¬м—җ мӮ¬мҡ©лҗҳлҠ” мөңмҙҲмқҳ м¶ңн•ҳлҘј м•һл‘” лҢҖлҸҷл§Ҙ к°Җм§Җ л””л°”мқҙмҠӨмқҙлӢӨ. лҢҖлҸҷл§Ҙ к°Җм§Җ л°Ҹ кіҒк°Җм§Җ кө¬м„ұн’Ҳмқҙ лӘЁл‘җ н•ҳлӮҳмқҳ лҢҖлҸҷл§Ҙм—җ кҙҖлҘҳлҘј м ңкіөн•ҳлҸ„лЎқ м„Өкі„лҗҳм–ҙ мәҗлүјлҹ¬к°Җ лҜёлҰ¬ мӮҪмһ…лҗң(pre-cannulated) мқҙ л””л°”мқҙмҠӨлҠ” к°Җм§Җ нҳҲкҙҖмқҙ лҚ®мқҙлҠ” мң„н—ҳм„ұмқ„ мөңмҶҢнҷ”н•ҳкі мқҙмӢқмқҙ лҚ” мҡ©мқҙн•ҳлҸ„лЎқ кі м•ҲлҗҗлӢӨ. лҳҗ к°Җм§Җ кө¬м„ұн’Ҳм—җлҠ” нҳҲм „ нҳ•м„ұмқ„ м Җн•ҙн•ҳлҸ„лЎқ кі м•Ҳлҗң м„ұлҠҘмқҙ кІҖмҰқлҗҳкі м§ҖмҶҚм„ұ мһҲлҠ” н—ӨнҢҢлҰ° м ‘м°© кё°мҲ мқё кі м–ҙмқҳ CBAS н—ӨнҢҢлҰ° м„ңн”јмҠӨ(CBAS Heparin Surface)к°Җ м Ғмҡ©лҸј мһҲлӢӨ.
кі м–ҙмқҳ лқјмқҙм–ё нғҖмјҖмҡ°м№ҳ(Ryan Takeuchi) лҢҖлҸҷл§Ҙ мӮ¬м—…л¶Җ ліёл¶ҖмһҘмқҖ вҖңмЈјмҡ” мһ„мғҒм—°кө¬м—җм„ң TBEлҘј мөңмҙҲлЎң мқҙмӢқн•ң кІғмқҖ нҳҲкҙҖ лӮҙ м№ҳлЈҢ кё°мҲ мқ„ кҙ‘лІ”мң„н•ҳкІҢ м ңкіөн•ҳл ӨлҠ” м§ҖмҶҚм Ғмқё л…ёл Ҙм—җм„ң нҡҢмӮ¬к°Җ мөңк·ј м–»мқҖ кІ°мӢӨвҖқмқҙлқјл©° вҖңмҡ°лҰ¬лҠ” мқҙ л””л°”мқҙмҠӨ л¶Җл¬ём—җм„ң л§ҺмқҖ вҖңм„ёкі„ мөңмҙҲвҖқкё°лЎқмқ„ м„ёмҡҙлҚ° мқҙм–ҙ мқҙлІҲм—җ мқҙ мҡ”лІ•мқ„ мөңмҙҲлЎң мЈјмҡ” лӢЁкі„лЎң м§„м „мӢңнӮҙм—җ л”°лқј м¶ңн•ҳ лӢЁкі„м—җ мһҲлҠ” нҳҲкҙҖ лӮҙ м№ҳлЈҢ л””л°”мқҙмҠӨлЎң м–ҙл Өмҡҙ лҢҖлҸҷл§Ҙк¶Ғ м§Ҳнҷҳ м№ҳлЈҢк°Җ к°ҖлҠҘн•ҳкІҢ лҗҗлӢӨвҖқкі л§җн–ҲлӢӨ.
TBEлҠ” м„ұмһҘн•ҳкі мһҲлҠ” нҳҲкҙҖ лӮҙ м ңн’Ҳкө°мқҳ мқјл¶ҖлЎң лҢҖлҸҷл§Ҙ м§Ҳнҷҳмқ„ нҡЁкіјм ҒмңјлЎң м№ҳлЈҢн•ңлӢӨлҠ” лӘ©н‘ңлҘј кіөмң н•ҳл©° лҶ’мқҖ нҸүк°ҖлҘј л°ӣкі мһҲлҠ” кі м–ҙмқҳ мһ„мғҒ м§Җмӣҗ нҢҖкіј көҗмңЎ н”„лЎңк·ёлһЁмңјлЎң л’·л°ӣм№ЁлҗңлӢӨ. мў…н•©м Ғмқё м ңн’Ҳ нҸ¬нҠёнҸҙлҰ¬мҳӨм—җлҠ” мҙқмһҘкіЁ лҸҷл§ҘлҘҳлӮҳ лҸҷл§ҘлҘҳмқҳ нҳҲкҙҖ лӮҙ м№ҳлЈҢлҘј м Ғмқ‘мҰқмңјлЎң лҜёкөӯ FDA мҠ№мқёмқ„ мөңмҙҲлЎң л°ӣмқҖ кё°м„ұ мһҘкіЁ к°Җм§Җ мһҘм№ҳ вҖҳкі м–ҙ мқөмҠӨнҒҙлЈЁлҚ” мһҘкіЁк°Җм§Җ кҙҖлӮҙ мқёкіөмӮҪмһ…л¬јвҖҷ(GOREВ® EXCLUDERВ® Iliac Branch Endoprosthesis, IBE)мқҙ нҸ¬н•ЁлҸј мһҲлӢӨ. нҡҢмӮ¬лҠ” кҙҖл Ё нҸ¬нҠёнҸҙлҰ¬мҳӨмқҳ мҷ„м„ұлҸ„лҘј лҶ’мқҙкё° мң„н•ҙ лҜёкөӯкіј лёҢлқјм§Ҳм—җм„ң кі м–ҙ мқөмҠӨнҒҙлЈЁлҚ” нқүліөл¶Җ к°Җм§Җ кҙҖлӮҙ мқёкіөмӮҪмһ…л¬ј(GOREВ® EXCLUDERВ® Thoracoabdominal Branch Endoprosthesis, TAMBE)м—җ лҢҖн•ң мһ„мғҒ м—°кө¬лҘј 진н–ү мӨ‘мқҙлӢӨ.
лӢӨлҘё кіім—җ нҚјк°ҖмӢӨ л•ҢлҠ” м•„лһҳ кі мң л§ҒнҒ¬ мЈјмҶҢлҘј м¶ңмІҳлЎң мӮ¬мҡ©н•ҙмЈјм„ёмҡ”.
 http://www.koreabiz.org/news/view.php?idx=9267
http://www.koreabiz.org/news/view.php?idx=9267
